Veeva – lo specialista del software cloud-based per il settore life sciences – illustra come alcune aziende farmaceutiche leader, che operano in ambito Rare Disease, si adoperano per rendere disponibile in tempi rapidi il valore clinico e commerciale dei loro sforzi in termini di ricerca e sviluppo, utilizzando tecnologia e dati per trasformare il loro approccio ed accelerare la disponibilità di nuovi trattamenti ai pazienti.
Secondo le ultime stime, solo nell’Unione Europea, sono circa 30 milioni le persone affette da una malattia rara. La diagnosi rimane dolorosamente lenta e i pazienti ne subiscono le conseguenze. Con 6.000-8.000 patologie rare di cui tenere conto, gli operatori sanitari (HCP) spesso non riescono ad individuare i sintomi all’interno di popolazioni di pazienti relativamente piccole (cinque persone o meno su 10.000). La giusta diagnosi può richiedere anni o anche non arrivare mai.
Le aziende farmaceutiche che cercano di fornire trattamenti efficaci per le malattie rare sono alla ricerca del proverbiale ago nel pagliaio. Già durante la fase di sviluppo trovare, reclutare e mantenere i pazienti negli studi clinici è una grande sfida. Per completare con successo le fasi di ricerca e sviluppo, è indispensabile integrare senza soluzione di continuità i dati clinici, la revisione dei documenti e la presentazione delle domande di autorizzazione da parte di più funzioni. Nella fase di commercializzazione, poi, i referenti medico-scientifici (MSL) devono identificare e coinvolgere gli esperti giusti per definire la strategia medica.
Dopo il lancio, l’accesso ai medici di riferimento della specifica patologia rappresenta una ulteriore sfida: il 65% degli HCP incontra tre o meno aziende farmaceutiche in Europa.
Non sorprende che al 95% delle malattie rare non corrisponda un trattamento approvato.
Le aziende farmaceutiche che operano in ambito rare diseases hanno l’obiettivo di rendere disponibile in tempi rapidi il valore clinico e commerciale dei loro sforzi in termini di ricerca e sviluppo. Vediamo come alcune aziende leader stanno utilizzando tecnologia e dati per trasformare il loro approccio ed accelerare la disponibilità di nuovi trattamenti ai pazienti.
Accelerare lo sviluppo di nuovi prodotti
Le aziende farmaceutiche in ambito rare, per poter completare gli studi clinici, hanno necessità di reclutare pazienti in modo rapido, economico e in siti di ricerca sufficientemente differenziati. L’evoluzione accelerata dell’industria verso i digital trials consente, con costi relativamente ridotti, di identificare pazienti sparsi nella popolazione. Tuttavia, il loro coinvolgimento in una sperimentazione può essere complesso, soprattutto se la sperimentazione è basata su soggetti che si trovano in un determinato sito e le loro condizioni di salute si aggravano.
Per preservare la retention, è necessario che i pazienti possano scegliere con maggiore facilità come partecipare agli studi, se di persona o con mezzi digitali, in base al loro stato di salute quotidiano e alle loro preferenze individuali. Le soluzioni wearable, l’ePRO (electronic Patient-Reported Outcomes) e i dispositivi di monitoraggio remoto possono certamente aiutare a monitorare lo stato di salute dei pazienti. Ma la tecnologia deve tenere il passo con questi sviluppi scientifici. Oggi, i sistemi tradizionali di acquisizione elettronica dei dati (EDC) non forniscono più ai team di studio un quadro completo e i responsabili dei dati non hanno gli strumenti per gestire su scala i dati non tradizionali.
Una volta terminata la sperimentazione, le aziende devono trovare il modo di ridurre i tempi e i costi di sviluppo. Un approccio integrato alla tecnologia e ai dati può contribuire ad accelerare lo sviluppo di nuovi prodotti, migliorando la collaborazione interfunzionale e definendo una single source of truth in ambito clinico, regolatorio, di sicurezza e di qualità.
A titolo esemplificativo, la rapida crescita di Alexion ha determinato un quadruplicamento del numero di studi clinici in tre anni, senza però sovraccaricare il personale, i processi o i sistemi. L’azienda è riuscita a costruire una base flessibile per sostenere l’accelerazione della sua pipeline di sviluppo, migliorando la gestione dei dati clinici e la supervisione degli studi, consolidando le informazioni regolatorie e aumentando l’efficienza nella gestione dei documenti di qualità. Michael Sauter, senior director of global regulatory operations, osserva: “Le funzioni aziendali coinvolte si sono rese conto del grande vantaggio di avere un unico sistema in trovare tutto ciò che serve“.
I dati consentono un approccio di precisione
Una volta ricevuta l’approvazione per il nuovo farmaco, si tratta di identificare e costruire relazioni con gli stakeholder di riferimento per la patologia, decisivi per la strategia medica.
Trovare le persone giuste in ambito rare disease non è semplice e ciò comportare il dover dare priorità solo a un ristretto numero di esperti. Come commenta Malcolm Crooks, chief operations officer di COUR Pharmaceuticals: “ho lavorato a un programma nel Regno Unito in cui c’erano solo 300 pazienti in tutto il Paese affetti da una specifica malattia, con i dati archiviati in un unico registro a Salford, vicino Manchester. Lavorare a stretto contatto con un opinion leader è stata una sfida, ma anche un’opportunità per comprendere meglio il loro ecosistema e capire come supportare le esigenze dei pazienti con le nostre soluzioni“.
Questo impegno di alto valore richiede una preparazione meticolosa. Tuttavia, gli MSL devono identificare e raggiungere rapidamente (e con largo anticipo rispetto al lancio) esperti clinici, opinion leader digitali e leader delle comunità locali. Per essere efficaci nella loro attività di informazione, gli MSL hanno bisogno di un unico punto di accesso a informazioni rilevanti e aggiornate sugli interessi clinici e scientifici dei principali stakeholder. Se guardiamo alla frequenza con cui i dati di ricerca clinica vengono discussi sui social media, i team di Medical Affairs che si affidano a un monitoraggio manuale potrebbero facilmente perdere di vista gli ultimi sviluppi, quando avrebbero invece bisogno di accedere sistematicamente ai feed dei social media e ad altre risorse pubblicate, così da essere completamente preparati prima di parlare con un esperto.
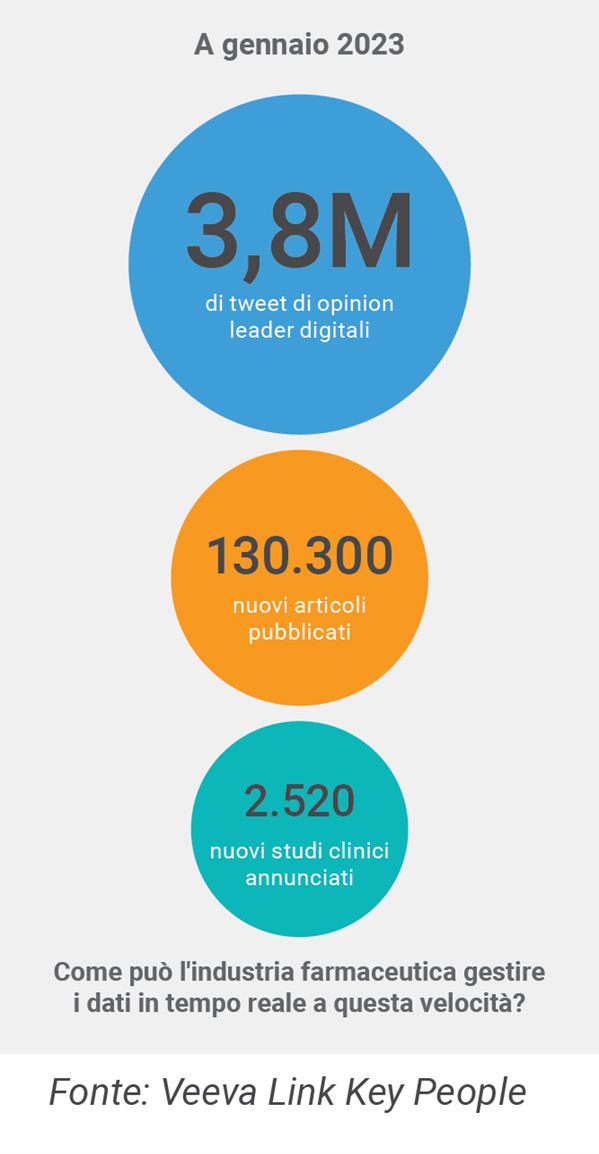
Nella fase di lancio di un farmaco, le aziende si preparano all’accesso al mercato e prioritizzano medici e centri in base a rilevanza e specialità. Un’azienda focalizzata sulle rare disease, ad esempio, ha ottimizzato il proprio programma di lancio grazie alla disponibilità di dati in tempo reale sull’intero ecosistema che circonda il suo farmaco.
Con un numero limitato di pazienti per i propri farmaci, le aziende in ambito rare devono saper sfruttare in modo efficace le risorse disponibili. Per questo è fondamentale che i team sul campo apprezzino il valore della nuova tecnologia e inizino a utilizzarla. Elodie Privat, sales analytics and operations lead di Novartis Gene Therapies, si riferisce al lancio di un farmaco per l’atrofia spinale e muscolare: “Ogni volta che lanciamo un nuovo medicinale in un Paese, abbiamo bisogno di dati accurati per gli operatori sanitari e le specialità. Se non si dispone di dati accurati, non si crea fiducia e gli utenti non adotteranno la tecnologia“.
I dati possono determinare il percorso da seguire, anche quando i percorsi dei pazienti sono complessi (come nel caso delle malattie autoimmuni rare). In Nord America, i dati dei pazienti end-to-end sono sempre più utilizzati per mappare i passaggi più probabili dalla diagnosi al trattamento. Ad esempio, ANI Pharmaceuticals ha utilizzato una combinazione di segmentazione avanzata e tecnologia per creare team sul campo specializzati in pochi mesi, dotandoli di informazioni su diversi segmenti di pazienti, aree terapeutiche e professionisti del settore. I team stanno avendo un buon successo perché riescono a customizzare il dialogo con i medici sulla base dei pazienti che visitano e dei farmaci che prescrivono.
Infine, migliorare la conoscenza di una malattia rara da parte degli HCP è fondamentale per ridurre i tempi di diagnosi. A tal fine, gli operatori sanitari hanno bisogno di un accesso continuo alle informazioni che consentano loro di effettuare una diagnosi precoce, ad esempio di essere istruiti sui sintomi di cui potrebbero non essere consapevoli e che rischiano di ignorare. In un’altra azienda, i team hanno condiviso con gli operatori sanitari le informazioni sul percorso del paziente (comprese alcune surveys sull’esperienza del paziente) e altri dati. Combinando i dati del CRM (ad esempio, quando un membro del team ha incontrato per l’ultima volta un certo medico) con fonti di dati esterne (ad esempio, i dati demografici degli HCP e le attività online), il team ha potuto sviluppare relazioni significative con i medici più importanti dell’ecosistema sanitario. Questo, attraverso relazioni consolidate con gli operatori sanitari, consente in ultima istanza di fornire ai pazienti trattamenti innovativi in tempi più rapidi.
Una sfida senza precedenti
Le sfide poste dalle patologie rare richiedono un approccio diverso nel processo end-to-end di lancio di un nuovo farmaco. Tecnologia e dati accurati devono integrarsi in ogni fase. I team clinici, commerciali e di market access devono essere in grado di condividere le informazioni e collaborare più rapidamente per accelerare il processo di immissione sul mercato.
Non avendo margine di errore, le aziende in ambito rare disease hanno bisogno di una visione precoce della redditività del mercato per commercializzare nuovi trattamenti su scala. Inoltre, devono dotare gli MSL degli strumenti giusti per lavorare in modo ibrido, in base alle diverse preferenze ed esigenze degli HCP.
Nonostante la dimensione delle sfide, le aziende leader stanno progredendo rapidamente verso la scoperta e la commercializzazione di trattamenti per i cinque pazienti su 10.000 affetti da malattie rare.