
Nel laboratorio di nano-fabbricazione dell’IBM Almaden Research Center Luisa Bozano gestisce progetti che si collocano nell’ambito della sensoristica e riguardano anche il funzionamento del cervello.
Sono progetti multidisciplinari che cercano di affrontare due classi di problemi differenti: da una parte lo sviluppo di un naso elettronico intelligente che possa simulare sensibilità, selettività e complessità del naso umano; dall’altra un progetto focalizzato sulla fabbricazione di nuove interfacce bioelettroniche per applicazioni neuroingegneristiche svolto in collaborazione con due gruppi italiani, il gruppo di Neuroingegneria e Bio-nano Tecnologie dell’Università degli Studi di Genova che fa capo al professor Sergio Martinoia e il gruppo di Dispositivi Elettronici Avanzati dell’Università di Cagliari della professoressa Annalisa Bonfiglio. In questo articolo Andrea Spanu ci offre una descrizione del progetto.
Dispositivi innovativi per applicazioni elettrofisiologiche
Come funziona il cervello? In che modo la fitta rete di comunicazione tra i neuroni è tradotta nella percezione del mondo che ci circonda? Quali sono i meccanismi cellulari alla base di malattie neurodegenerative quali Alzheimer e Parkinson? È possibile contrastarne farmacologicamente l’avanzamento o prevenirne la comparsa?
Le risposte a queste domande richiedono conoscenze in diverse discipline che spaziano dalla biologia alla farmacologia, dalle neuroscienze all’elettronica, passando per la psicologia e le scienze cognitive.
Tutte queste domande trovano però un punto in comune nella necessità di accedere all’informazione contenuta nel più straordinario fenomeno fisico conosciuto: il potenziale d’azione cellulare.
Chi è l'autore
Andrea Spanu è un ricercatore dell’Università di Cagliari e si occupa dello sviluppo di interfacce bioelettroniche di nuova generazione per applicazioni neurofisiologiche sia in vivo che in vitro. Attualmente è responsabile di un progetto altamente multidisciplinare che prevede la collaborazione tra le università di Cagliari e Genova e l’IBM Almaden Research Center a San Jose, California. Ha contribuito alla pubblicazione di diversi articoli scientifici nel campo delle interfacce bioelettroniche e della sensoristica organica, e la sua tesi di dottorato è stata selezionata tra le migliori tesi del 2015 dall’editore Springer e pubblicata nel programma “Springer Thesis”.
L’importanza della cosiddetta “bioelettricità animale” era chiara già alla fine del 1700 quando Luigi Galvani, con i suoi celeberrimi studi sugli anfibi, gettò le basi della nostra attuale conoscenza sulla conduzione elettrica del segnale nervoso. Ma bisogna attendere i primi anni 50 del ventesimo secolo, e gli studi di Alan Lloyd Hodgkin e Andrew Huxley sulla conduzione del potenziale d’azione nell’assone gigante del calamaro, per avere una reale comprensione dei meccanismi che regolano la genesi e la propagazione del potenziale d’azione cellulare: le risposte alle precedenti domande accuratamente celate nel movimento di una manciata di ioni attraverso un doppio strato lipidico.
Due famiglie di dispositivi
A partire da questi primi importantissimi studi (che valsero agli autori il premio Nobel per la medicina nel 1963) e grazie all’avvento delle moderne neuroscienze, l’approccio a singola cellula cominciò a mostrare i suoi limiti.
Nuove tecnologie si resero necessarie per approfondire le nostre conoscenze sul funzionamento del sistema nervoso centrale umano. Fu in questo periodo che due tipologie di dispositivi cominciarono a prendere piede all’interno della comunità scientifica: i Micro Electrode Array (MEA) e, qualche anno dopo, piattaforme di test basate su un particolare dispositivo a semiconduttore, l’Ion Sensitive Field Effect Transistor, o ISFET, che fu introdotto da Piet Bergveld nei primi anni sessanta.
L’avvento di questi due dispositivi, con la loro capacità di rilevare simultaneamente i segnali provenienti da centinaia (e successivamente migliaia) di neuroni e di stimolarne l’attività, aprì le porte a un enorme filone di ricerca che ha portato negli ultimi 20-25 anni ad una più profonda comprensione dei fenomeni legati all’attività cerebrale e all’introduzione di nuove discipline quali le Brain Machine Interface (interfacce cervello macchina) e nuovi approcci sperimentali in vitro basati sullo studio dell’attività elettrica di reti neuronali 2D.
Cervello in vitro: la terza dimensione
Lo studio in vitro sui modelli 2D ha portato ad interessanti scoperte nell’ambito delle neuroscienze computazionali e ampliato le frontiere della ricerca in ambito farmacologico. Nonostante ciò, i limiti delle reti neuronali 2D sono evidenti se si considera la loro estrema semplicità rispetto all’organo di cui costituiscono il modello.
Un ulteriore passo in avanti è costituito dalla realizzazione di modelli cosiddetti 3D, i quali permettono di estendere enormemente la complessità del sistema: un passo in avanti verso lo studio su un vero e proprio cervello in provetta e un’organizzazione della rete più “brain-like”.
Lo studio su modelli 3D rappresenta dunque un cambio di paradigma nell’ambito delle neuroscienze computazionali e della farmacologia e, come in qualunque disciplina in ambito scientifico, ogni cambio di paradigma è sempre accompagnato da un parallelo avanzamento tecnologico.
Lo studio di questo vero e proprio cervello in vitro necessita infatti di dispositivi che permettano lo studio della propagazione dei potenziali d’azione non solo sul piano ma anche nella terza dimensione; ed è qui che entrano in gioco la decennale esperienza nella nano-fabbricazione del sensor-lab presso l’IBM Almaden Reseach Center e la collaborazione con il gruppo di Neuroingegneria e Bio-nano Tecnologie dell’Università degli Studi di Genova (gruppo pioniere nell’ambito delle interfacce bioelettroniche).
L’approccio utilizzato consiste nella realizzazione di strutture 3D depositate tramite electro-plating a partire da elettrodi planari con l’ausilio di apposite guide realizzate in corrispondenza degli elettrodi stessi tramite processi fotolitografici.
La tecnica permette di realizzare strutture tridimensionali alte fino a oltre 100 µm capaci sia di rilevare che di stimolare l’attività elettrica neuronale a diversi livelli all’interno della coltura.
La versatilità di questo approccio permette la realizzazione di dispositivi con diverse geometrie su svariati tipi di substrati, quali per esempio substrati metallici, di vetro o su membrane plastiche flessibili ed economiche.
Estrema flessibilità
Ma l’attività del sensor-lab nell’ambito delle interfacce bioelettroniche non si limita allo sviluppo di queste innovative matrici di elettrodi 3D.
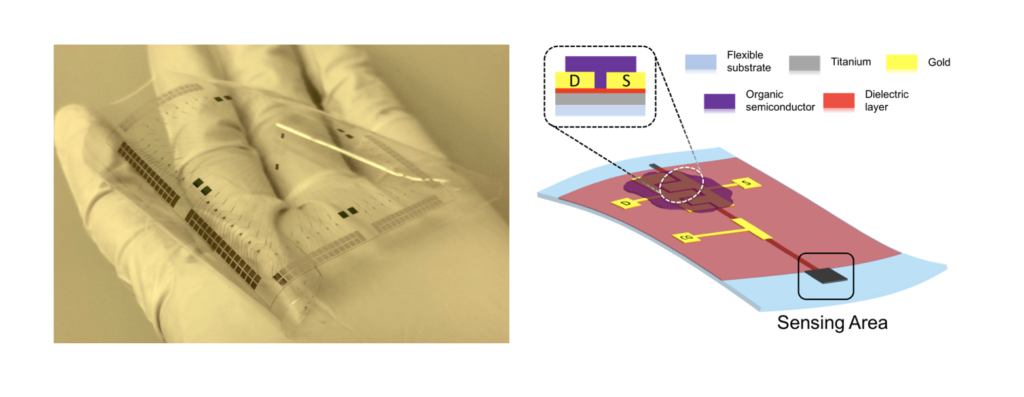
In collaborazione con il laboratorio di Dispositivi Elettronici Avanzati dell’Università di Cagliari (gruppo altamente qualificato nell’ambito dell’elettronica organica) infatti, è attualmente in corso la realizzazione di nuovi dispositivi basati su particolari transistor organici per applicazioni elettrofisiologiche in vitro.
Il dispositivo cardine di questa nuova famiglia di sensori è chiamato Organic Charge Modulated FET (OCMFET), un versatile sensore di carica sviluppato presso il DEAlab che ha già dato risultati promettenti in ambito elettrofisiologico.
L’aspetto forse più interessante di questo dispositivo organico (basato cioè non su semiconduttori cristallini convenzionali ma su particolari materiali semiconduttivi principalmente costituiti da carbonio) è la sua estrema flessibilità, non solo in quanto realizzato su substrati plastici flessibili, trasparenti, biocompatibili ed economici ma soprattutto in relazione al suo funzionamento.
La sua particolare struttura a gate flottante infatti, fa dell’OCMFET un sensore di carica estremamente sensibile, e le variabili di cui questo dispositivo può fare sensing dipendono dal modo in cui una particolare zona del dispositivo, chiamata area sensibile, viene fabbricata. Questo fa dell’OCMFET un interessante candidato per la realizzazione di innovative piattaforme multi-sensing per applicazioni elettrofisiologiche sia in vivo che in vitro, capaci di monitorare simultaneamente diversi parametri d’interesse biomedico quali l’attività elettrica cellulare e il pH, ma anche, e non solo, temperatura, stress meccanico e pressione.
Il dispositivo attualmente in fase di progettazione e realizzazione, chiamato Micro OCMFET Array (MOA), è realizzato su materiali plastici flessibili e biocompatibili ed è costituito da 56 OCMFET progettati in modo da unire in un solo substrato sensori di attività elettrica e sensori di pH dedicati al monitoraggio dell’attività metabolica cellulare.
Specificamente progettato per lo studio in vitro di reti neuronali, sia 2D che 3D, il MOA si propone come alternativa flessibile ed economica ai dispositivi attualmente in commercio e che possa allo stesso tempo dare ai ricercatori nel campo delle neuroscienze la possibilità di progettare esperimenti sempre più interessanti ed innovativi.







![NTT Data e Train a supporto dei trial clinici complessi NTT Data e Train, spin-off dell'Istituto Clinico Humanitas, collaborano per trasformare la ricerca medica attraverso l'intelligenza artificiale generativa e l'uso di dati sintetici. Questa sinergia mira a ridurre i tempi di accesso alle cure, anticipare le risposte terapeutiche e ottenere risultati clinici affidabili, soprattutto nelle malattie rare dove i dati sono limitati. Il report "Generative AI and synthetic data for clinical application" evidenzia come queste tecnologie possano innovare la progettazione e validazione dei trial clinici. ???? Maggiori dettagli nell'articolo completo: [link all'articolo] #AI #Sanità #RicercaClinica #Innovazione #NTTData #Train #Humanitas](https://static.tecnichenuove.it/01health/2025/04/NTT-data-1-100x70.png)
